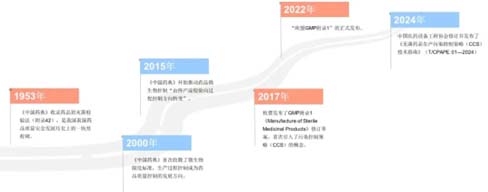
Nella prima metà di quest’anno, la piattaforma informativa standard del gruppo nazionale ha annunciato le linee guida tecniche per le strategie di controllo della contaminazione (CCS) per la produzione di farmaci sterili (T/CPAPE 01-2024) organizzate dalla China Pharmaceutical Equipment Engineering Association. La bozza della linea guida è stata pubblicata il 7 settembre 2023 e ha sollecitato le opinioni del pubblico. È stata ufficialmente implementata il 1 giugno 2024. Sebbene questa linea guida non sia obbligatoria, fornisce riferimenti tecnici per le società di produzione farmaceutica e di ricerca e sviluppo, unità di progettazione di impianti, produttori di apparecchiature, ecc., e svolge un importante ruolo guida nella migliorare il controllo dell’inquinamento nel processo di produzione farmaceutica.
L’ascesa del concetto di strategia di controllo della contaminazione (CCS) non è casuale, ma una scelta inevitabile per generazioni di professionisti medici nella ricerca della qualità dei farmaci.
01
Da dove viene la strategia di controllo della contaminazione (CCS)?
Da dove viene la strategia di controllo della contaminazione (CCS)?
Nel dicembre 2017, quando l'UE ha pubblicato la bozza rivista dell'Allegato 1 delle GMP "Produzione di medicinali sterili" ("Allegato 1 delle GMP dell'UE"), è apparso per la prima volta il concetto di strategia di controllo della contaminazione (CCS), ed è stato ufficialmente confermato con la pubblicazione dell'"EU GMP Annex 1" il 22 agosto 2022. Allo stesso tempo, anche il concetto di rilascio dei parametri è apparso nel campo visivo del pubblico. Man mano che le condizioni di implementazione continuano a maturare, il controllo del processo di produzione di farmaci sterili si sposterà ulteriormente dal rilevamento al controllo del processo e al rilascio dei parametri.
02
Cos’è esattamente una strategia di controllo della contaminazione (CCS)?
L'allegato 1 alle GMP dell'UE definisce chiaramente la strategia di controllo della contaminazione (CCS) [2] :

Le agenzie competenti definiscono l'ambito di applicazione della strategia di controllo della contaminazione (CCS) come segue [3] [4] [5] :

03
Perché dovresti preoccuparti della strategia di controllo della contaminazione (CCS)?
L’essenza della strategia di controllo della contaminazione (CCS) è controllare i possibili rischi di contaminazione in tutti gli aspetti del processo di produzione dei farmaci e rimuovere/ridurre/prevenire il più possibile i rischi di contaminazione attraverso misure scientifiche e sistematiche, in modo da garantire che le imprese può produrre prodotti di alta qualità, sicuri e affidabili. Una volta che si verifica la contaminazione, il risultato non è solo uno spreco di materiale, ma anche un’indagine dettagliata e la correzione della fonte di inquinamento, che richiede molto tempo e manodopera e causa anche una grande perdita; nei casi più gravi, le autorità di regolamentazione indagheranno e puniranno, o addirittura ritireranno il prodotto dal mercato, il che è ancora più insopportabile per l'impresa.
Le fasi tipiche nello sviluppo e nel mantenimento di una strategia di controllo della contaminazione sono le seguenti:
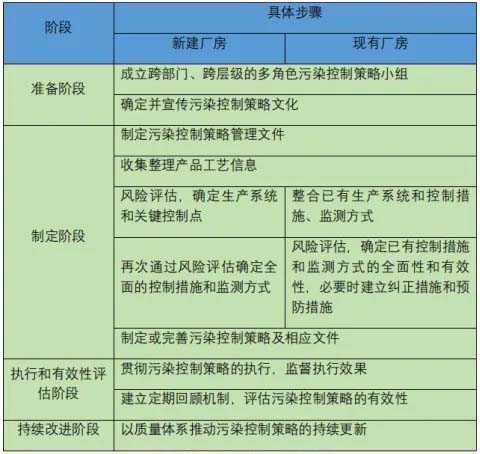
Esempio di passaggi per sviluppare e mantenere una strategia di controllo della contaminazione
Sulla base di ciò, non è difficile vedere che la strategia di controllo della contaminazione (CCS) è un requisito inevitabile per adattarsi allo sviluppo del settore al di fuori della Cina. Se le aziende farmaceutiche interessate vogliono mantenere la conformità e la competitività, devono rendersi conto che la formulazione e il mantenimento della strategia di controllo della contaminazione (CCS) è un processo dinamico e continuo. Se vogliono stare al passo con gli standard internazionali, devono incorporare la strategia di controllo della contaminazione (CCS) nel sistema di qualità dell'azienda, tenere registri corrispondenti, produrre documenti rilevanti, riassumerli e aggiornarli regolarmente.
04
Elementi di controllo di una strategia di controllo della contaminazione (CCS)
Strutture di fabbrica
Le strutture di fabbrica sono una garanzia necessaria per la qualità della produzione dei farmaci. Le aziende farmaceutiche devono organizzare il personale professionale e tecnico per pianificare e progettare strutture di fabbrica in base ai requisiti delle diverse forme di dosaggio dei farmaci ed eseguire la verifica pertinente per confermare che le loro prestazioni possano soddisfare le esigenze previste. Nel ciclo di vita degli impianti industriali, la buona progettazione da sola non è sufficiente. Anche il suo utilizzo, la manutenzione, la riparazione e il monitoraggio quotidiano sono collegamenti indispensabili. Allo stesso tempo, le strutture degli stabilimenti devono essere riviste regolarmente per garantire che possano continuare a controllare efficacemente l’inquinamento. La formulazione della strategia di controllo della contaminazione è inseparabile dalla considerazione complessiva dell'intero ciclo di vita degli impianti di fabbrica.
Prendendo come esempio le camere bianche, la scelta dei materiali decorativi è direttamente correlata alla pulizia, alla sicurezza, alla durata, ai costi operativi, ecc. Considerato l’uso diffuso di disinfezione con perossido di idrogeno (VHP). nelle camere bianche, requisiti più elevati sono posti sulla resistenza alla corrosione di partizioni per camere bianche .
In qualità di fornitore di soluzioni di assemblaggio per decorazioni per camere bianche/laboratori, Pharma United ha lanciato Pannello Asepticlean® Anti-VHP in risposta a questa richiesta. Dopo i rigorosi test interni di Pharma United e la verifica sul campo del cliente, questo prodotto ha dimostrato vantaggi significativi:
- Lo spessore del rivestimento superficiale di Farmaceutica Unita Pannello Asepticclean® Anti-VHP è pari a ≥150μm, che è molto superiore a quello della normale lamiera di acciaio colorato pre-rullo rivestita (PPGI), mostrando un'eccellente resistenza al perossido di idrogeno. Inoltre, rispetto al rivestimento in fluorocarburo rivestito pre-rullo (PVDF) e al rivestimento in poliestere (PE), Pharma United Asepticclean® Anti-VHP Pannello ha prestazioni migliori.
- Rispetto all'acciaio inossidabile SS304, Pannello Asepticclean® Anti-VHP non solo evita l'affaticamento visivo, ma le sue proprietà di facile manutenzione riducono notevolmente anche i costi di manutenzione. È anche più conveniente nel prezzo, offrendo agli utenti una scelta conveniente.
attrezzatura
La gestione delle apparecchiature comprende tutte le attività in tutte le fasi del ciclo di vita delle apparecchiature. Un efficace sistema di gestione delle apparecchiature può prevenire e controllare al massimo la potenziale contaminazione nel processo di produzione farmaceutica. La progettazione, l'uso, la manutenzione e la riparazione delle apparecchiature, la revisione regolare, ecc. sono tutti punti chiave della strategia di controllo della contaminazione. Un controllo insufficiente di qualsiasi fattore o la mancanza di connessione tra fattori può portare a difetti nell'intera strategia di controllo della contaminazione.
Allo stesso tempo, sebbene il monitoraggio ambientale sia un modo efficace per riflettere il livello di inquinamento ambientale, la variabilità del metodo di monitoraggio stesso è relativamente elevata. Le imprese devono rendersi conto che il livello di garanzia della sterilità non dipende dal monitoraggio ambientale e dal rilevamento tramite simulazione di processi asettici. I dati di monitoraggio ambientale riguardano più l’identificazione dei cambiamenti nel controllo ambientale piuttosto che fornire informazioni quantitative sui livelli microbici ambientali e sui livelli di particelle.
In generale, da quando la National Medical Products Administration (NMPA) ha gradualmente aderito all'ICH ed è diventata un richiedente formale del PIC/S, le leggi e i regolamenti farmaceutici cinesi si sono ulteriormente allineati agli standard internazionali, il che ha portato al miglioramento degli standard di ispezione GMP cinesi, coordinamento degli standard di ispezione e rafforzamento delle forze di regolamentazione. Sia che le aziende farmaceutiche cinesi producano e vendano localmente o esportino all’estero, stabilire un valido sistema di strategia di controllo della contaminazione (CCS) è una misura necessaria per far fronte alla supervisione straniera e migliorare la qualità dei prodotti aziendali.































